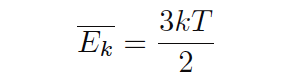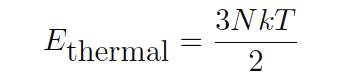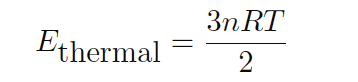آشنايي با دما
آشنايي با دما
آشنايي با دما ، كاربرد ان در صنعت پتروشيمي
دما واحد اندازه گيري ميانگين انرژي جنبشي مولكولي در يك ماده است .
اين مفهوم براي گازهاي تحت فشار كم ، اسان است ، جايي كه مولكول هاي گاز بطور تصادفي در مورد ان پيجيده ميشوند .
ميانگين انرژي جنبشي (حركتي) اين مولكول هاي گازي دما را براي ان مقدار گاز تعيين مي كند .
حتي يك مولكول وجود دارد كه بيانگر رابطه بين انرژي جنبشي متوسط (EK) و درجه حرارت (T) براي گازيكتايي (مولكول تك اتمي) است .
EK = ميانگين انرژي جنبشي مولكول هاي گازي (ژول)
k = ثابت بولتزمن
T = دماي مطلق گاز (كلوين)
انرژي حرارتي يك مفهوم متفاوت است :
مقدار انرژي جنبشي كل براي اين حركت مولكولي تصادفي .
اگر ميانگين انرژي جنبشي به عنوان 3kT/2 تعريف شود ، پس از ان كل انرژي جنبشي براي تمام مولكولهاي موجود در يك گاز موناتوميك بايد اين مقدار باشد تا تعداد كل
مولكولها N در نمونه گاز :
اين ممكن است به طور مساوي از نظر تعداد خال هاي بنزين به جاي تعداد مولكول ها (تعداد قابل ملاحظه اي بزرگ براي هر نمونه واقع گرايانه) بيان شود :
اترمال = كل انرژي حرارتي براي يك نمونه گاز (ژول)
n = مقدار گاز موجود در نمونه (خال)
R = ثابت گاز ايده ال (8.315 ژول در هر مول - كلوين)
T = دماي مطلق گاز (كلوين)
[
گرما به عنوان تبادل انرژي حرارتي از يك نمونه به نمونه ديگر ، از طريق هدايت (تماس مستقيم) ، همرفت (انتقال از طريق يك مايع در حال حركت) يا تابش (انرژي منتشر شده)
تعريف ميشود .
اگر چه شما اغلب اصطلاحات انرژي حرارتي و گرماي مورد استفاده را به صورت متناوب پيدا خواهيد كرد .
به عنوان مثال نشان دهنده يك مولكول واحد گاز با سرعت ثابت دماي مشخصي خواهد داشت .
دو يا سه مولكول كه به سرعت يكسان حركت مي كنند دماي يكساني دارند ، اما در كنار هم انرژي حرارتي بيشتري را نسبت به هر يك از انها به تنهايي در نظر مي گيرند .
گرما يا كاهش يا افزايش انرژي حرارتي با انتقال انرژي است .
برچسب: ،